Неврология
Молекулярнонацеленные (таргетные) клеточные препараты – новаторское решение проблемы повышения эффективности и безопасности технологий регенеративной медицины в лечении нервных и психических болезней
Введение. Объём мирового рынка клеточных препаратов, применяемых в медицине в 2015 году, составил более 2,5 млрд. долларов США, а к 2020 году по данным аналитиков составит около 10 млрд. долларов США. Препараты стволовых клеток (СК) уже достаточно долго и безопасно используются в лечении целого ряда нервных болезней человека. Клиническая эффективность терапевтического воздействия клеточных препаратов в лечении болезней центральной нервной системы (ЦНС) достаточно не высока и составляет в среднем от 35 до 51%. Это достаточно не высокий процент эффективности терапевтического средства, если учесть, что эффективность большинства фармакологических средств, по заявленным разработчиками показаниям, достигает до 80- 85%. С другой стороны, с позиций классической неврологии, оценивая эффективность клеточной терапии в лечении болезней ЦНС становится очевидным, что абсолютная терапевтическая не курабельность большинства заболеваний ЦНС с использованием стандартных конвенциональных методов лечения составляет почти 90-92%, что заставляет по новому и с надеждой посмотреть на определенную, хотя и явно недостаточную эффективность лечения этих заболеваний с применением препаратов СК и ПК. При целом ряде заболеваний ЦНС применение препаратов СК и ПК в их комплексном лечении является зачастую единственным возможным методом выбора. Однако, многими академическими учеными и клиницистами даже эта эффективность клеточных препаратов считается сомнительной и кажется не убедительной с позиций доказательной медицины. Поэтому необходимо понять, как можно повысить эффективность применения препаратов СК. С чем связаны достаточно низкие показатели эффективности препаратов СК и пессимизм в разработке и создании новых клеточных препаратов у отдельных клиницистов и фармакологических компаний? Почему до сих пор препараты СК не заняли того достойного места в арсенале современных терапевтических средств поврежденной нервной системы, которые они могли бы занять с учетом своих потенциальных возможностей?
Целью настоящей статьи явился ретроспективный анализ эффективности и безопасности многолетнего применения СК в лечении различных нервных болезней и психических расстройств путем проведение мультифакторного критического анализа материалов историй болезни пациентов с заболеваниями ЦНС, получавших стационарное лечение с использованием различных типов аутологичных и аллогенных СК , а также анализ причин и следствий низкой эффективности клинического применения различных препаратов СК человека при нервных болезнях и презентация новой методологии и стратегии высокоэффективного применения – молекулярнонацеленной (таргетной) клеточной терапии в лечении неврологических заболеваний и психических расстройств
Материалы и методы исследования. Статья основана на клиническом исследовании и ретроспективном многолетнем изучении 2780 историй болезни 458 пациентов с различными органическими заболеваниями центральной нервной системы ( ЦНС) и 391 пациенте контрольной группы , проходивших многолетнее стационарное экспериментальное лечение в клинике восстановительной интервенционной неврологии и терапии «НейроВита» ( Россия , г. Москва) с сентября 2002 года по март 2016 года в рамках отраслевой программы Российской академии медицинских наук «Новые клеточные технологии – медицине» ( руководитель программы академик РАМН проф. В.К. Ярыгин, координатор исследований проф. А.С.Брюховецкий). Распределение больных по нозологиям нервных болезней представлено в таблице 1.
Таблица 1.
Распределение больных с различными неврологическими заболеваниями получавших терапию стволовыми клетками
| № п/п | Нозологии нервных болезней | Количество и/болезни | Количество пациентов в эксперимен-тальной группе | Контрольная группа (Кол-во пациентов) |
|---|---|---|---|---|
| 1. | Травматическая болезнь спинного мозга | 1714 | 309 | 88 |
| 2. | Травматическая болезнь головного мозга | 216 | 31 | 34 |
| 3. | Рассеянный склероз | 92 | 16 | 12 |
| 4. | Боковой амиотрофический склероз | 104 | 22 | 24 |
| 5. | Последствия геморрагического и ишемического инсульта | 179 | 27 | 79 |
| 6. | Дисциркуляторная энцефалопатия | 164 | 26 | 56 |
| 7. | Хронические вегетативные состояния | 43 | 6 | |
| 8. | Детский церебральный паралич | 24 | 5 | 2 |
| 9. | Мультиформная глиобластома. | 156 | 5 | 75 |
| 10. | Нейродегенеративные заболевания. | 88 | 11 | 21 |
| 11. | Итого | 2780 | 458 | 391 |
Распределение больных по возрасту и полу и области повреждения спинного мозга представлены в таблице 2.
Таблица 2.
Распределение больных с неврологическими заболеваниями по возрасту и полу проходивших в лечение стволовыми клетками
| № п/п | Нозологии нервных болезней | Количество Мужчин/ Средний возраст абс | Количество Мужчин/ Средний возраст % | Количество женщин/ Средний возраст абс | Количество женщин/ Средний возраст % | Контрольная группа Мужчины абс | Контрольная группа Мужчины % |
|---|---|---|---|---|---|---|---|
| 1. | Травматическая болезнь спинного мозга (397) | 253 | 33,46 | 56 | 32,48 | 88 | 36,25 |
| 2. | Травматическая болезнь головного мозга (65) | 23 | 31,85 | 8 | 32,2 | 34 | 38,8 |
| 3. | Рассеянный склероз (28) | 5 | 40,8 | 11 | 40,5 | 12 | 37,6 |
| 4. | Боковой амиотрофический склероз (46) | 13 | 46,53 | 9 | 48,22 | 24 | 55,5 |
| 5. | Последствия геморрагического и ишемического инсульта (106) | 19 | 49,00 | 8 | 56,37 | 79 | 58,12 |
| 6. | Дисциркуляторная энцефалопатия (82) | 19 | 48,47 | 7 | 40,14 | 56 | 50,78 |
| 7. | Хронические вегетативные состояния (6) | 5 | 36,4 | 1 | 34 | - | - |
| 8. | Детский церебральный Паралич (7) | 2 | 25,50 | 3 | 26,00 | 2 | 18 |
| 9. | Мультиформная Глиобластома (80) | 4 | 29,50 | 1 | 52,00 | 75 | 54,97 |
| 10 | Нейродегенеративные заболевания | 7 | 63,6 | 4 | 36,3 | 21 | 5,6 |
| 11. | Итого | 350 | 76,4 | 108 | 23,6 | 370 | 100 |
Распределение больных в зависимости от стратегии применения технологий регенеративной медицины (консервативная, хирургическая и комбинированная) представлены в таблице 3.
Больные с различными неврологическими заболеваниями включенными в программу находились под постоянным динамическим наблюдением и изучались в течение 3-8 лет, проходя контрольные стационарные обследования через каждые 3 месяца с обязательным проведением клинического обследования, включающего в себя неврологический осмотр, МРТ с контрастным усилением ( у 50 пациентов с ТБСМ проведена трактография проводящих путей на основе диффузно-тензорного исследования спинного мозга), нейрофизиологическое обследование в виде электронейромиографии (ЭНМГ), ЭНМГ с соматосенсорными вызванными потенциалами, тестовые исследования по разным шкалам (шкала ASIA , шкала FIM), рентген-контроль коленных и тазобедренных суставов в соответствие с существующим протоколом научных исследований, утвержденным ученым советом и этическим комитетом Российского государственного медицинского университета им Н.И.Пирогова (РГМУ).
Таблица 3.
Распределение больных с неврологическими заболеваниями в зависимости от стратегий применения технологий регенеративной медицины
| № п/п | Нозологии нервных болезней | Консервати-вная стратегия (клеточная терапия) абс | Консервати-вная стратегия (клеточная терапия) % | Хирургичес-кая стратегия (тканевая инженерия) абс | Хирургичес-кая стратегия (тканевая инженерия) % | Комбинированная стратегия (ткане-вая инженерия и клеточная терапия) абс | Комбинированная стратегия (ткане-вая инженерия и клеточная терапия) % |
|---|---|---|---|---|---|---|---|
| 1. | Травматическая болезнь спинного мозга | 257 | 83.1 | 12 | 3,9 | 40 | 12,9 |
| 2. | Травматическая болезнь головного мозга | 21 | 67,7 | 2 | 6,4 | 8 | 25,8 |
| 3. | Рассеянный склероз | 10 | 62,5 | - | - | 6 | 37.5 |
| 4. | Боковой амиотрофический склероз | 15 | 68,1 | 3 | 13,6 | 4 | 18,2 |
| 5. | Последствия геморрагического и ишемического инсульта | 18 | 66,7 | 3 | 11.1 | 6 | 22.2 |
| 6. | Дисциркуляторная энцефалопатия | 26 | 100 | - | - | - | - |
| 7. | Хронические вегетативные состояния | 2 | 33.3 | 2 | 33.3 | 2 | 33.3 |
| 8. | Детский церебральный паралич | 5 | 100 | - | - | - | - |
| 9. | Мультиформная глиобластома | 5 | 100 | - | - | - | - |
| 10. | Нейродегенеративные заболевания | 11 | 100 | - | - | - | - |
| 11 | Итого | 370 | 80,78 | 22 | 4.8 | 66 | 14.4 |
Все промежуточные и заключительные отчеты по данным исследованиям ежегодно были предоставлены в ректорат Национального медицинского исследовательского университета им Н.И. Пирогова и Министерство здравоохранения РФ. Для лечения разных типов повреждений нервной ткани ГМ и СМ применялись различные виды клеточных препаратов : препарат мобилизованных из костного мозга гемопоэтических стволовых и прогенеторных (CD34+,CD45-) клеток (ГСК) ( производитель препарата ЗАО Клиника «НейроВита»), нейральных стволовых клеток ( CD 133+), выделенные из обонятельной выстилки пациента ( производитель препарата Государственный научный центр социальной и судебной психиатрии им.В.П.Сербского ) и мезенхимальные стромальные стволовые клетки, выделенные из костного мозга пациента ( производитель препарата ФГБУ Федеральный научно-клинический центр ФМБА России). Весь клеточный материал был стандартизирован и сертифицирован государственными научно-исследовательскими учреждениями.
Полученные результаты.
Оценка эффективности клеточной терапии во многом зависела от нозологической принадлежности заболевания и целей применения СК. Анализ результатов эффективности при различных нозологиях болезней ЦНС представлен в таблице 4.
Таблица 4.
Анализ эффективности клеточной терапии в результате длительного применения препаратов СК при различных неврологических заболеваниях
| № п/п | Нозологии нервных болезней | Всего обследовано абс / % | Нет эффекта абс / % | Ухудшение абс / % | Эффективная абс / % | Высоко Эффективная абс / % |
|---|---|---|---|---|---|---|
| 1. | Травматическая болезнь спинного мозга | 257 / 100% | 63 / 24.5% | 5 / 1.9% | 177 / 68.8% | 12 / 4.7% |
| 2. | Травматическая болезнь головного мозга | 21 / 100% | 7 / 33.3% | 1 / 4.7% | 10 / 47.6% | 3 / 14.2% |
| 3. | Рассеянный склероз | 10 / 100% | 2 / 20% | 2 / 20% | 4 / 40% | 2 / 20% |
| 4. | Боковой амиотрофический склероз | 15 / 100% | 5 / 33.3% | - / - | 10 / 66.6% | - / - |
| 5. | Последствия геморрагического и ишемического инсульта | 18 / 100% | 4 / 22.2% | 2 / 11.1% | 10 / 55.5% | 2 / 11.1% |
| 6. | Дисциркуляторная энцефалопатия | 26 / 100% | 4 / 15.3% | 1 / 3.8% | 17 / 65.4% | 4 / 15.3% |
| 7. | Хронические вегетативные состояния | 2 / 100% | - / - | - / - | 2 / 100% | - / - |
| 8. | Детский церебральный паралич | 5 / 100% | - / - | - / - | - / - | 5 /100% |
| 9. | Мультиформная глиобластома | 5 / 100% | 2 / 40% | 1 / 20% | 2 / 40% | - / - |
| 10. | Нейродегенеративные заболевания | 11 / 100% | 4 / 36.6% | 1 / 9% | 6 / 54.5% | - / - |
| 11 | Итого | 370 / 100 % | 91 / 24.5% | 13 / 3.5% | 238 / 64.3% | 28 /7.5% |
Нейрофизиологические показатели восстановления электрической проводимости по спинному мозгу после проведенной клеточной терапии представлены на рисунках 1-6
Обсуждение полученных результатов
По результатам наших исследований эффективность применения препаратов СК в режиме клеточной терапии наиболее эффективная и составляет до от 35 % до 56 %. Эффективность тканевой инженерии и биоинженерии составляет около 41-49.6%. Повысить эффективность технологий регенеративной медицины выше 56 % нам не удалось несмотря на разнообразие применения различные клеточные препараты. При этом применения клеточных препаратов достаточно безопасно . Наиболее вероятно, что основная причина всех существующих проблем, связанных с ограниченными возможностями разработки, создания, получения, оценки эффективности и внедрении в клинику клеточных препаратов СК и ПК заключается в серьезных ошибках научной методологии их применения в клинике, не конкретной постановке целей и задач лечения и определения основных показаний для их применения. Отсутствие четких молекулярных целей для воздействия на патологическую клетку не позволяют получить заданный клеточный эффект ( пролиферации, деления, дифференцировки и т.д.) в ней, который бы хотел получить врач. Сегодня основным, определяющим, а нередко и единственным показанием к применению является «регенерация клеток поврежденной нервной ткани» (НТ) головного мозга (ГМ) или спинного мозга (СМ). Целью же молекулярного воздействия большинства клеточных препаратов СК и ПК является «общая стимуляция регенеративных процессов» в нервной ткани человека. Несомненно, существуют и другие показания к применению СК при отдельных заболеваниях мозга: замена клеток иммунной системы больного путем трансплантации гемопоэтических СК костного мозга при рассеянном склерозе, регуляция эффекторных функций опухолевых СК при злокачественных новообразованиях головного мозга и т.д. Но именно феномен внутритканевой регенерации, стал основным и определяющим показанием и фундаментальной точкой приложения большинства препаратов СК и даже определил название новой области современной медицины, использующей СК для лечения болезней, как «регенеративная медицина». При этом, регенеративная медицина, как новая область мирового здравоохранения, применяет препараты СК преимущественно системно (внутривенно, внутриартериально, интратекально), но не направленно для стимуляции общих процессов регенерации во всех органах и системах организма человека. Для стимуляции локального регенеративного потенциала СК и ПК применяются преимущественно в тканевой инженерии органов и биоинженерии тканей и органов человека.
Новым направлением в мировой регенеративной медицине в области нервных болезней стал нейроресторативный подход, основанный на применении СК для реставрации структуры поврежденной нервной ткани (H.Honung et al,2012). Нейрореставрация НТ ГМ и СМ предполагает структурную реконструкцию ткани с заменой её элементов ( клеток, сосудов, синапсов, волокон и .д.). В целях регенерации пострадавшей нервной ткани (НТ) ГМ и СМ при одних и тех же заболеваниях ЦНС в нейрореставрологии широко применяются различные виды нативных ( изолированных из пуповинной крови, костного мозга, жировой ткани, обонятельной выстилки носа и т.д.) и культивированных линий аутологичных и аллогенных ( эмбриональных, фетальных, плюрипотентных, генно-инженерных и т.д.) тканеспецифических СК и прогенеторных клеток (ПК) человека: нейральные СК и ПК (НСК и НПК), гемопоэтические СК и ПК(ГСК и ГПК), мезенхимальные стромальные СК (МССК и МПК) и др. Предпринимаются попытки выделить наиболее эффективные препараты СК для определенной нозологии, определить их оптимальную дозу, пути введения и возможные комбинации с внеклеточными матриксами.
Общим в методологии различных научно-клинических подходов к восстановлению ЦНС с применением СК и ПК являются фундаментальные научные факты, доказывающие усиление и активацию процессов регенерации в зоне прямого контакта СК и ПК с клетками поврежденной НТ. Изучены на молекулярном уровне и фундаментально описаны основные нейробиологические феномены обеспечивающие направленный трансфер СК и ПК в зону повреждения ( ишемии, воспаления, кровооизлияния и т.д. ГМ и СМ человека: а ) феномен патотропизма СК и ПК, заключающийся в их направленной миграции и хоуминге в зону повреждения на градиент концентрации воспаления; б) феномен «клеточной адгезии и прилипания» к патологической клетке; в) эффект «рядомстоящего» ( by stander effect) – управляющее и регуляторное воздействие на клетки поврежденной НТ. Доказано в эксперименте, что основными механизмами регенеративного действия почти всех клеточных препаратов СК в поврежденном мозге являются: 1. Слияние трансплантированных СК и ПК препарата с поврежденными клетками нервной ткани; 2. Установление новых синаптических контактов между поврежденными клетками нервной ткани; 3. Биологически активное секреторное или регуляторное воздействие СК на поврежденные нервные клетки ( S. Kuroda et al., 2012).
Таким образом, сегодня мы знаем о СК и ПК и механизмах их действия так много, что эти знания уже не понятно как систематизировать и применять на практике. Однако мы ждем от молекулярных биологов, клеточных биологов, культуральщиков и нейробиологов каких-то новых «чудесных» знаний о свойствах и маркерах СК, которые позволят нам повысить их эффективность и позволят прогнозировать реальные эффекты их клинического применения. Но не стоит ждать «чуда» и сенсационных открытий в области СК. За последние 25 лет необходимые открытия в области изучения СК уже почти все сделаны. Надо научиться пользоваться тем арсеналом существующих возможностей и инструментов, который уже сегодня известен и который может широко применяться в клинике в настоящее время.
Очевидным заблуждением современной регенеративной медицины было огромное желание исследователей и врачей излечить больных с различными нейродегенеративными заболеваниями за счет стимуляции и активации единого внутриклеточного механизма общесистемного воздействия клеточных препаратов на процессы регенерации в нервной ткани. При этом было забыто, что молекулярные механизмы повреждения и восстановления НТ ГМ и СМ при клинически и морфо-функционально схожих нейродегенеративных процессах крайне отличны как по характеру молекулярного повреждения, так и по уровню вовлеченности в патологический процесс различных информационных параметров клетки. Например, если в слабоумии при сосудистой деменции лежат преимущественно нарушения метаболизма клеток ( метаболома) клеток нервной ткани вследствие хронической сосудистой ишемизации белого и серого вещества ГМ, то при болезни Альцгеймера основные молекулярные нарушения обуславливающие интеллектуальный дефект вследствие нейродегенерации связаны с тяжелыми протеомными нарушениями обмена тау-белков и в-амилоидных белков в нейронах коры ГМ. В то же время интеллектуально-мнестические расстройства обусловленные нейрорегенерацией при болезни Паркинсона связаны , в первую очередь, с нарушениями передачи дофамина (ДОФА) в синапсах стриопалидарной зоны ГМ , то есть нарушениями «секретома» нейронов в подкорковой области ГМ. Следовательно и восстановление функций этих пострадавших клеток разных участков НТ ГМ не может быть решено только через генерацию, стимуляцию и активацию общих механизмов репарации и нейрорегенерации. Основными мишенями и целями для СК и ПК в пострадавших клетках НИ должны стать конкретные молекулярные пути сигнальной трансдукции, способные запустить или заблокировать конкретный путь для их регенерации. Выбор этого конкретного внутриклеточного пути в поврежденных клетках нервной ткани ГМ и СМ и может стать основной целью геномно-постгеномных исследований пострадавших клеток НТ больного и проведения молекулярнонацеленного векторного регуляторного воздействия на них.
Считаем, что основной акцент современных исследований СК и ПК должен быть сосредоточен на создании новых классов клеточных препаратов с заданными свойствами. « Но какими должны быть эти свойства СК и ПК и как их получить ?» - это центральный вопрос всей мировой регенеративной медицины. По-видимому, они должны быть развиваться в русле существующих трендов продвижения достижений современной молекулярной биологии и молекулярной медицины, основываться на геномных и полнотранскриптомных технологиях исследования экспрессии генов и их роли в этиопатогенетических механизмах развития заболевания, а также базироваться на постгеномном исследовании протеома и секретома применяемых клеточных препаратов.
Основным трендом большинства научных исследований начала 21 века и столбовой дорогой научного прогресса в современной мировой фармакологии стала разработка и создание молекулярнонацеленных (таргетных) препаратов. Социально-экономические достижения этого инновационного научного тренда впечатляют своими фантастическими результатами. Например, создание современных таргетных противоопухолевых фармакологических препаратов в мировой онкологии позволило продлить общую продолжительность жизни населения в США и Евросоюзе на 25-30 лет. В современной фармакологической индустрии создание таргетных препаратов основано на глубоком изучении и молекулярном анализе пострадавших в патогенезе болезни путей внутриклеточной сигнальной трансдукции (ПВКСТ) в патологических клетках при разных нозологиях нервных и психических болезней, выявлении целей (акцепторных белков) на мембране этих клеток или белков в структуре ПВКСТ, воздействие на которые позволит или блокировать или активировать конкретные ПВКСТ и запустить или остановить определенные эффекторные функции этих клеток ( апоптоз, пролиферация, митоз, инвазивность и т.д.). Высокоточное попадание белков- лигандов, а также лигандов в виде моноклональных антител (МКА) или иРНК как элементов таргетного препарата в акцепторные белки позволяет максимально эффективно управлять эффекторными функциями патологических клеток и достигать выраженного клинического эффекта лечения болезни.
Однако у фармакологической таргетной терапии (ФТТ) есть очень серьезный недостаток, который зачастую «перекрывает» её достоинства. Молекулы белков –лигандов и лиганды в виде МКА и иРНК могут не избирательно действовать на акцепторные белки ПВКСТ почти всех клеток организма с которыми они контактируют в процессе циркуляции их в крови, ликворе, лимфатической жидкости и т.д. и это является причиной возможных грозных осложнений этой терапии. Поэтому, для точности молекулярного нацеливания и исключения осложнений современной ФТТ, данная терапия направлена только на патоспецифические белки ПВКСТ, появляющиеся в процессе патогенеза или канцерогенеза болезни. Другими словам, для целенаправленного воздействия только на патологически измененные белки ПВКСТ и их блокирование, мишенями ФТТ могут быть только патоспецифические или онкоспецифические молекулы патологических белков. Данная фармакологическая терапия не пригодна для управления здоровыми клеточными системами и регуляцией клеточных систем с незначительным повреждением ПВКСТ. Создание таргетных клеточных препаратов в лечении нервных болезней может значительно повысить эффективность и безопасность лечения и улучшить качество жизни пациентов с заболеваниями и повреждениями головного мозга (ГМ) и спинного мозга (СМ) и создать уникальные условия регуляции биологическими процессами в нервной ткани пациента.
Клеточная таргентая терапия (КТТ) открывает принципиально новые горизонты для регуляции и управления эффекторными функциями поврежденных клеток (нейронов, нейроглии, микроглии и т.д.) и сосудов нервной ткани. Это обусловлено рядом уникальных нейробиологических феноменов свойственных клеточным препаратам, изготовленным из стволовых клеток (СК) и клеток прогенеторов (КП). Во-первых, эти клеточные системы (КС) всегда достигнут патологические клетки хозяина путем хоуминга и направленной миграции (патотропизма) СК и ПК и сами придут в патологический очаг органа. Они идут к патологическим клеткам по градиенту концентрации воспаления, независимо от его генеза ( ишемии, инфекции, повреждения, геморрагии и т.д.). Во - вторых, по механизму клеточной адгезии эти клетки всегда «прилипнут» исключительно к патологическим клеткам. И в третьих, нейробиологический феномен «рядомстоящего» обеспечит целенаправленное воздействие белков-лигандов и лигандов в виде иРНК секретома этих КС на объект регуляции. Таким образом, КТТ может быть использована, как для терапевтического воздействия на специфические так и не специфические ПВКСТ, то есть на ПВКСТ не пострадавшие в процессе патогенеза болезни.
Рассмотрим возможности и перспективы КТП на конкретных примерах двух нервных заболеваний с принципиально разным патогенезом заболевания: 1. Злокачественной глиальной опухоли головного мозга - мультиформной глиобластоме (МГБ) и 2. Хроническом повреждении спинного мозга (ПСМ). При МГБ основной задачей КТТ является подавление пролиферации, миграции и инвазивности ОСК (СD133+) МГБ. При ПСМ КТТ должна быть направлена, наоборот, на активацию пролиферации, митоза и регенерации клеток нервной ткани в зоне повреждения. Наши теоретические и экспериментальные постгеномные исследования МГБ (Брюховецкий А.С., 2014) показали, что основная методология разработки и создания молекулярнонацеленных (таргетных) клеточных препаратов при этой патологии должны строиться на основании установленных фундаментальных молекулярно-биологических научных фактов и нейробио-логических феноменов о МГБ. 1. В канцерогенезе МГБ ведущую роль занимают митотические, пролиферативные и миграционные процессы в опухолевой стволовой клетке (ОСК), формирующейся в результате воздействия канцерогенов из нейральных стволовых клеток (НСК), приводящие к 4-5-ти мутациям в НСК; 2. В протеомной структуре ОСК МГБ от 57% до 67% занимают онкоспецифические белки, то есть протеины не встречающиеся у здорового человека и поэтому управление ОСК через стандартные ПВКСТ резко ограничены; 3. Управляющее и регуляторное воздействие на миграционные, инфильтративные и пролиферативные процессы в МГБ возможно только при воздействии на определенные ПВКСТ в ОСК не пострадавшие в результате канцерогенеза: внутриклеточный путь фокальной адгезии (ВКПФА) и внутриклеточный путь интегринов (ВКПИ). 4. Мембранные белки этих путей (белки CXCL1, CD81, TPT1, Cas6 и AXL) могут стать основными мишенями для таргетной клеточной терапии МГБ. Белками- лигандами, секретируемыми НСК, способными подавить пролиферацию и рост МГБ может быть целый спектр белков способных к белок-белковому взаимодействию и в том числе белок фоллистатина. Анализ секретома НСК осуществляется путем протеомного картирования и профилирования нормальной сигнальной интенсивности белков, молекулы которых способны осуществить горизонтальное ( на мишени внутри ПВКСТ) или вертикальное ( на белки –акцеторы мембраны клеток) таргетное воздействие на ОСК. Наличие в секретоме НСК белка фоллистатина в определенной концентрации позволяет расценивать данный клеточный препарат как таргетный препарат. Наши данные полностью подтверждают эксперименальные исследования шведских ученых ( Staflin K, Zuchner T, Honeth G, Darabi A, Lundberg C, 2009) о роли фоллистатина в блокировании пролиферации ОСК МГБ. Гемопоэтические СК (ГСК) также могут рассматриваться как таргетные клеточные препараты, если в их секретоме будет достаточная концентрация фоллистатина. Этого можно добиться путем не генетической модификации транскриптома ГСК и ГПК, путем их предобработки низкомолекулярными химическими соединениями (пертурбогенами), способными изменить экспрессию определенных генов этих клеток. Таким пертурбогеном может выступать, например, банальная ацетилсалициловая кислота.
При травме спинного мозга основной задачей КТТ является запуск и активация ПВКСТ митоза, пролиферации и активация регенерации поврежденных клеток СМ. Основные эффекторные пути для активации регенерации и конкретные таргетные молекулы для нацеливания на них хорошо известны: увеличивает регенерацию после повреждения ПВКСТ STAT3 phosphorylation c молекулярной мишенью STAT3/gp130, рост аксонов в периферической нервной системе связан с ПВКСТ mTOR signaling c молекулярной мишенью pTEN deletion, аксональная регенерация в центральной нервной системе связана с ПВКСТ SOCS3 deletion c мишенью JAK/STAT signaling, ПВКСТ PSAF expression с молекулярной мишенью ERK-mediated signaling, которая способствует ацетилированию при ассоциированной регенерации и т.д.
Таким образом, основные молекулярные мишени белков -акцепторов для активации путей регенерации (mTOR signaling, JAK/STAT signaling, Myc signaling, PI3K/Akt signaling, Atf3/CREB signaling, RAC1 signaling, STAT3&C-Jun, Rho signaling, Notch signaling, SMAD signaling, eIF5A signaling) позволяют воздействовать на регуляцию и обратную связь основных патогенетических нейробиологические процессы происходящие в СМ при повреждении СМ: Energy Metabolism, Inflammatory Response, Oxidative Stress, Cytoskeletal, Vascular Changes, Axonal Regeneration. Обнаружение белков – лигандов для направленного молекулярного воздействия на данные мишени поврежденных клеток в ПСМ может быть найдено путем биоинформационного компьютерного анализа с использованием международных баз данных белок-белковых взаимодействий. Перечень белков- лигандов для воздействия на конкретные мишени ПВКСТ клеток ПСМ является важным арсеналом КТТ. Анализ протемного картирования секретомов ГСК,ММСК, НСК позволяет подобрать в базе данных (банке клеточных препаратов) КС с высокой концентрацией требуемых белков – лигандов в секретомах и использовать их для эффективной терапии ПСМ.
Заключение. Таким образом, применение КТП в технологиях регенеративной медицины может значительно повысить безопасность и эффективность терапии нервных и психических болезней, а стандартизация и сертификация КС, полученных из СК и ПК путем протеомного картирования и профилирования их секретомов, позволит создать регистр клеточных препаратов с молекулярнонаправленным секретомом, определенной нозологической специализации. Подбор КС с заданными белками лигандами в секретомах позволил значительно увеличить эффективность КТП и увеличить их нейроресторативные возможности при различных нервных болезнях.
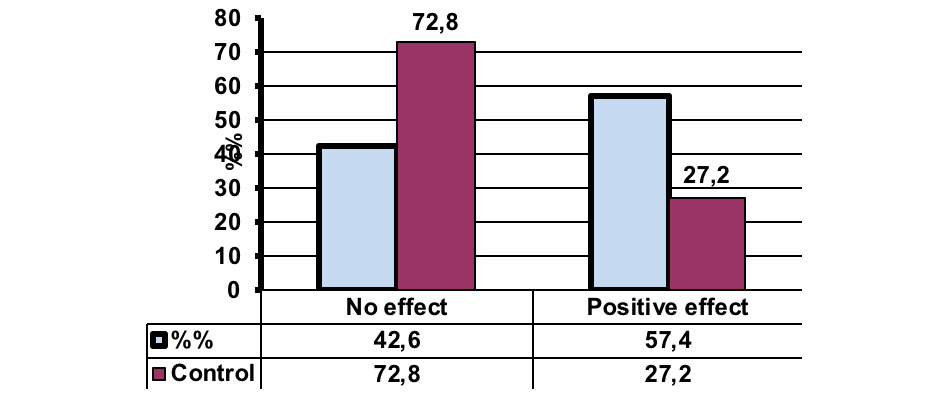 Рисунок 1. Общая эффективность терапии повреждений спинного мозга мобилизованными гемопоэтическими аутологичными стволовыми клетками человека
Рисунок 1. Общая эффективность терапии повреждений спинного мозга мобилизованными гемопоэтическими аутологичными стволовыми клетками человека
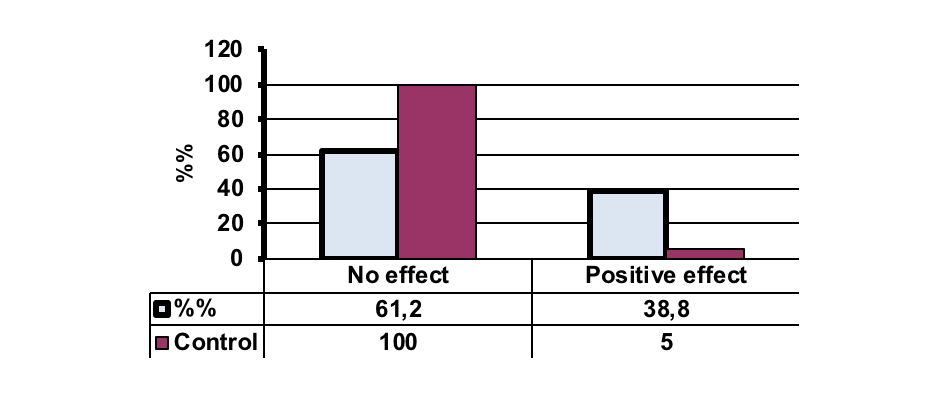 Рисунок 2. Общая эффективность восстановления чувствительности после терапии мобилизованными аутологичными гемопоэтическими стволовыми клетками при повреждении спинного мозга
Рисунок 2. Общая эффективность восстановления чувствительности после терапии мобилизованными аутологичными гемопоэтическими стволовыми клетками при повреждении спинного мозга
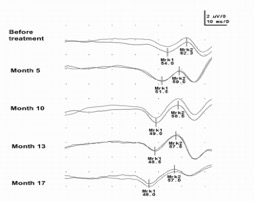 Рисунок 3. Динамика восстановления электрической проводимости (ССВП) по поврежденному спинному мозгу больного Г. на фоне лечения аутологичными гемопоэтическими стволовыми клетками в течение 18 месяце
Рисунок 3. Динамика восстановления электрической проводимости (ССВП) по поврежденному спинному мозгу больного Г. на фоне лечения аутологичными гемопоэтическими стволовыми клетками в течение 18 месяце
 Рисунок 4. Динамика восстановления электрической проводимости ( ССВП) по поврежденному спинному мозгу больного Д. на фоне лечения аутологичными гемопоэтическими стволовыми клетками в течение 18 месяцев
Рисунок 4. Динамика восстановления электрической проводимости ( ССВП) по поврежденному спинному мозгу больного Д. на фоне лечения аутологичными гемопоэтическими стволовыми клетками в течение 18 месяцев
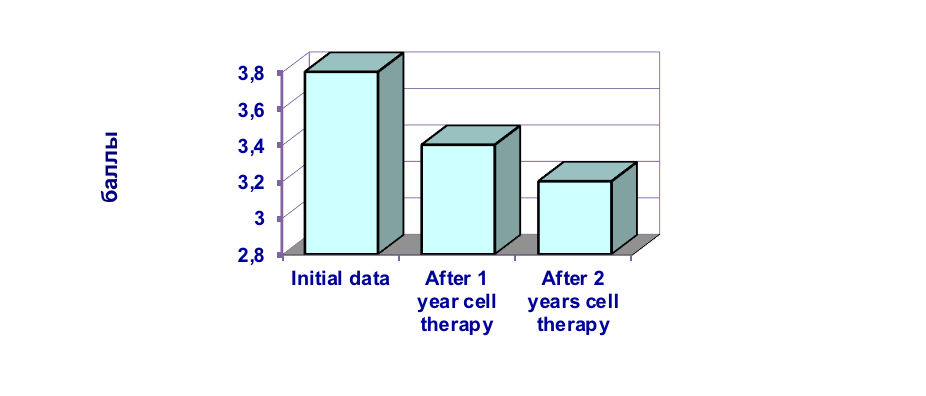 Рисунок 5. Динамика восстановления функции тазовых органов после терапии мобилизованными аутологичными гемопоэтическими стволовыми клетками
Рисунок 5. Динамика восстановления функции тазовых органов после терапии мобилизованными аутологичными гемопоэтическими стволовыми клетками
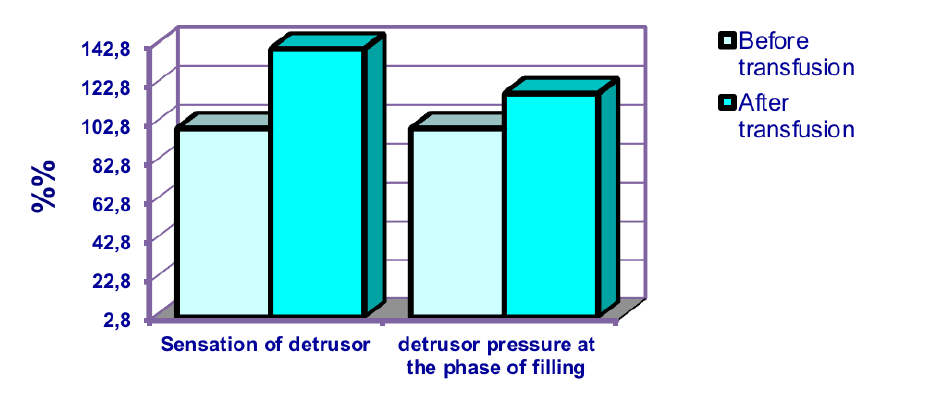 Рисунок 6.Динамика изменений уродинамических показателей у больных с повреждением спинного мозга после терапии мобилизованными аутологичными гемопоэтическими стволовыми клетками
Рисунок 6.Динамика изменений уродинамических показателей у больных с повреждением спинного мозга после терапии мобилизованными аутологичными гемопоэтическими стволовыми клетками






































